Exemple d'estimation d'une incertitude selon ISO 98-3
Le but de l’exercice est d'estimer l'incertitude de la concentration d'une solution de soude NaOH après Titrage avec une solution d'acide Chlorhydrique à 1 mol/L.
Méthode des 5 M:
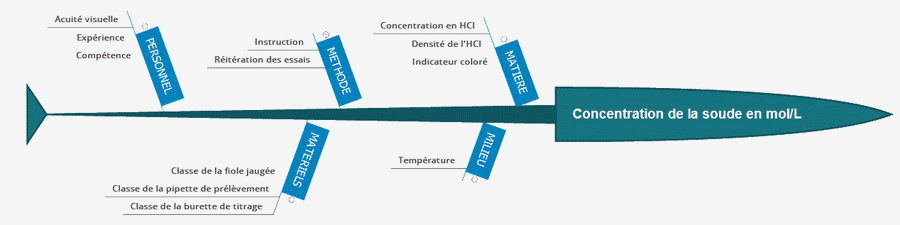
Données :
Titrant: HCL de qualité analytique de concentration moyenne de 37,25 % située entre 36,5 et 38% (11,8 à 12,39 Mol/L) avec une densité ρ = 1,19 kg/L et une masse molaire de 36,461 g/mol.
Dilution du titrant à 1 mol/L en diluant une aliquote de 20,6 ± 0,1 mL d'acide concentré dans une fiole jaugée de 250 mL de classe B: Erreur = 0,24 mL.
Solution: 25 mL de soude sont prélevées avec une pipette de 25 mL de classe B (± 0,08 mL) et transférées dans un becher conique.
Le titrage réalisé 3 fois est manuel avec une burette de 30 mL de classe B (± 0,06 mL) en utilisant un indicateur coloré (la Phénolphtaléine).
Préambule:
La concentration C en mol/L d'une solution peut s'exprimer à partir
de sa densité en g/L (exprimé en kg/L), de sa pureté
P en % (exprimé par un ratio entre 0 et 1), du volume de la solution
V
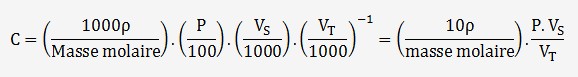
On en déduit l'incertitude à partir des 3 variables
de la fonction: (P, V
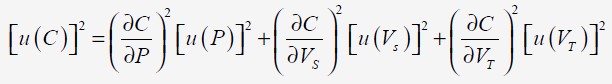
En dérivant la fonction C par rapport à chaque variable, on obtient:
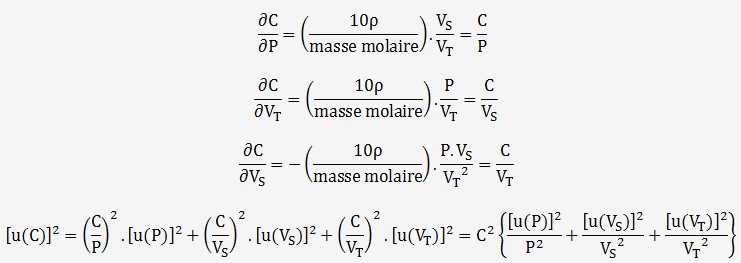
On en déduit que l'incertitude peut s'obtenir à partir des incertitudes relatives car les 3 variables sont indépendantes.
Détermination de la concentration C:
Le calcul donne:

Détermination des incertitudes:
| Variables |
Erreur |
Distribution | Incertitude
standard |
| P | 0,75 % | Rectangulaire | 0,75/√3=0,43 % |
| V |
0,1 mL | Rectangulaire | 0,1/√3=0,058 mL |
| V |
0,24 mL | Triangulaire | 0,24/√6=0,098 mL |
On en déduit l'incertitude combinée sur C:
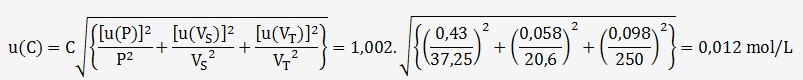
Avec un facteur d'élargissement k = 2, U(c) = 0,024 mol/L
La concentration peut donc s'écrire: C = (1,00 ± 0,02) mol/L
Résultats des titrages:
| Variables |
Titrage
N°1 |
Titrage N°2 | Titrage
N°3 |
| Lecture initiale: Li en mL | 27,20 | 29,30 | 28,70 |
| Lecture finale: Lf en mL |
2,10 | 4,30 | 3,70 |
| Volume versé (Li-Lf)
en mL |
25,10 | 25,00 | 25,00 |
L'incertitude sur Vv est liée à deux facteurs:
- L'incertitude liée à la tolérance
de la burette de ±0,06 mL que nous appellerons: U
- L'incertitude de répétabilité liée
aux 3 titrages que nous appellerons: U
et par conséquent:
![]()
On sait que:
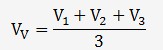
On en déduit le volume versé moyen: V
On en déduit l'incertitude à partir des 3 variables
de la fonction V
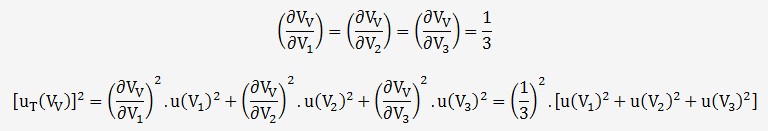
L'incertitude sur chaque volume est imputable à deux fois l'erreur de la burette puisqu'il y à une différence de deux lectures: ±0,06 mL
L'incertitude suit une loi rectangulaire, on peut donc écrire:

On en déduit que:
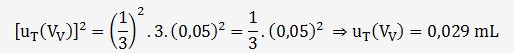
L'incertitude sur la répétabilité est
estimée à partir de l'écart-type des 3 volumes (V
Cet écart-type vaut 0,058 mL, le titrage à été répété 3 fois, on en déduit que:
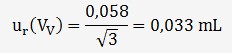
On peut donc estimer l'incertitude sur Vv:
![]()
Incertitude sur la concentration de la soude:
La relation chimique entre l'acide HCL et la soude NaOH étant stoechiométrique, 1 mole d'acide HCL neutralise 1 mole de soude NaOH.
Nous n'aurions normalement pas à vérifier la concentration de la soude qui doit être égale à C = 1,002 mol/L.
cette concentration est déterminée par la relation:
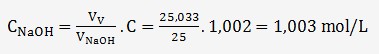
L'approximation provient de la moyenne des volumes et notamment de l'erreur du titrage N°1.
La formule ci-dessus nous permet de déterminer l'incertitude
sur C
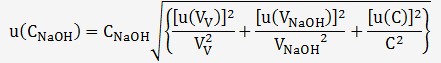
L'incertitude u(V
![]()
On en déduit l'incertitude sur la concentration de la soude:
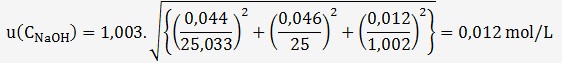
Avec un facteur d'élargissement k = 2, U(C
La concentration peut donc s'écrire: C
